Associata Dirigente di Ricerca
Associata Dirigente di Ricerca
Dipartimento Infrastrutture di Ricerca per le Risorse Biologiche Marine
Centro Microscopia Avanzata
Tel. +39 081 5833289 - +39 081 5833361
e-mail luigia.santella(at)szn.it
Interessi di ricerca
La ricerca della Dott.ssa Santella è focalizzata sui meccanismi strutturali e molecolari della trasduzione del segnale che inducono cambiamenti fisiologici negli ovociti e nelle cellule uovo durante la maturazione meiotica e la fecondazione. Negli ultimi due decenni, si è interessata allo studio delle fluttuazioni del Ca²+ intracellulare durante questi processi, utilizzando stelle marine e ricci di mare come organismi modello. La sua ricerca su ovociti immaturi e in fase di maturazione di stelle marine – cellule ideali per la microiniezione e l'analisi di imaging – ha stabilito che i segnali del Ca²⁺ durante la fecondazione possono essere innescati dall'effetto combinato di secondi messaggeri legati al Ca²⁺, come NAADP e InsP₃. Questi messaggeri svolgono ruoli distinti nell'inizio e propagazione della risposta del Ca²⁺ alla fecondazione, rispettivamente. Al contrario, il cADPr può avere una funzione modulatoria. Ha anche dimostrato che alcuni segnali del Ca²⁺ possono originarsi e propagarsi all'interno di specifici domini subcellulari, tra cui il nucleo e le regioni al di sotto della membrana plasmatica. In studi più recenti, la sua ricerca ha aperto la strada al concetto secondo cui l'actina corticale del citoscheletro influenza significativamente le modalità di aumento del Ca2+ intracellulare durante la fecondazione. Questa scoperta è stata estesa anche alle uova di riccio di mare.
Oltre alla sua ricerca, la Dott.ssa Santella è stata attiva nella promozione di collaborazioni internazionali e di scambi intellettuali, nonché nel miglioramento della formazione di studenti presso università straniere. Ha organizzato diversi simposi internazionali di successo e invitata a parlare a conferenze e congressi in Europa, Stati Uniti e Asia. Dal 1993 al 2018, ha visitato annualmente l'Asamushi Research Center for Marine Biology presso l'Università di Tohoku in Giappone per condurre ricerche sulle stelle marine locali. Inoltre, ha tenuto lezioni in programmi educativi sponsorizzati dall'EMBO e dalla NSF in Brasile e Uruguay.
Appointments and Memberships
2022 Sigma Xi Honor Society Member
2020 Member of the Editorial Board of Cells
2015-2024 Editor of Biochemical Biophysical Research Communications
2015 Member of the Scientific Committee of the European Calcium Society
2014 Member of the Editorial Board of Zoological Letters
2014-2024 Member of the Editorial Board of Zygote
2004-2009 Member of the Editorial Board of Physiological Reviews
2004 Member of the Academia Europaea
Invited Speaker at International Meetings/Symposia/Workshops/Conferences such as FEBS, Ca2+-Binding Proteins, and Ca2+ Function in Health and Disease, EMBO, FASEB Research, Gordon, and Advanced Courses.
Organizer of International Symposia
2019. Santella L. Biochemical Biophysical Research Communications Editorial Meeting, Naples, Italy, 6-8 December.
2013. Santella L. and Chun JT. International Symposium on: The dynamically active egg: The legacy of Ernest Everett Just (held to celebrate the 130th anniversary of the birth of Ernest Everett Just), Naples, 13 May.
2009. Santella L, De Natale G, Baffioni C, Cavalli A. Academia Europaea 21st Annual Conference on Risks, Environment and Sustainable Development, Naples, Italy. 24—26 September.
2004. Santella L, Cattaneo E, Rizzuto R, Carafoli E. EMBO Workshop on Calcium Signalling and Disease, Capri, Italy.
1997. Santella L, Bachs O, Nicotera P, Carafoli E. First European Conference on Calcium Signalling in the Cell Nucleus, Baia Paraelios, Italy. Reports on the conference have appeared in Cell (92:17-23, 1998) and Cell Calcium (22:313-319, 1997).
Special Issues Organizer
Special Issue on The Cell Biology of Fertilization (2023). In: Cells, Guest Editors: Santella L, Limatola N.
https://www.mdpi.com/journal/cells/special_issues/0W5YL3TJIE
Special Issue on Waves in Fertilization, Cell Division, and Embryogenesis (2021). In: Biosystems, Guest Editors: Santella L, Gordon R, Chen Z, Tuszynski J.
https://www.sciencedirect.com/journal/biosystems/special-issue/1022D42HXMT
Special Issue on Cytoskeletal Structure and Dynamics in Fertilization and Early Development (2019). In: Frontiers in Cell and Developmental Biology, Guest Editors: Santella L, Chun JT.
Special Issue on Actin Cytoskeleton Dynamics (2018). In: Biochemical Biophysical Research Communications. Guest Editors, Santella L, Mabuchi I. 506, 307-422.
Special issue on Fertilization and Early Development (2013). In: Biochemical Biophysical Research Communications. Guest Editors, Lennarz WJ, Santella L. 450, 1133-1230.
Publications (h-index: 39)
Selected Publications
Limatola N, Pirozzi M, Caramiello D, Chun JT, Santella L. (2025) The Binding of Concanavalin A to the Surface of Intact and Denuded Sea Urchin Eggs Affects the Fertilization Process by Altering the Structural Dynamics of Actin Filaments. Cells, 14(23), 1867; https://doi.org/10.3390/cells14231867
Limatola N, Chun JT, Schmitt JL, Lehn JM, Santella L. The Effect of Synthetic Polyamine BPA-C8 on the Fertilization Process of Intact and Denuded Sea Urchin Eggs. (2024) Cells, 13(17), 1477; https://doi.org/10.3390/cells13171477
Mangini M, Limatola N, Ferrara MA, Coppola G, Chun JT, De Luca AC. Santella L. (2024) Application of Raman spectroscopy to the evaluation of F-actin changes in sea urchin eggs at fertilization. Zygote, 32, 38-48; https://doi.org/10.1017/S0967199423000552
Limatola N, Chun JT, Chiba K, Santella L. (2023) Dithiothreitol Affects the Fertilization Response in Immature and Maturing Starfish Oocytes. Biomolecules, 13(11), 1659; https://doi.org/10.3390/biom13111659
Limatola N, Chun JT, Schneider SC, Schmitt JL, Lehn JM, Santella L. (2023) The Effect of Acidic and Alkaline Seawater on the F-Actin-Dependent Ca2+ Signals Following Insemination of Immature Starfish Oocytes and Mature Eggs. Cells, 12(5), 740; https://doi.org/10.3390/cells12050740
Santella L, Chun JT. (2022) Structural actin dynamics during oocyte maturation and Fertilization. Biochem Biophys Res Commun 633, 13-16; https://www.sciencedirect.com/science/article/pii/S0006291X22012438
Limatola N, Chun JT, Santella L. (2022) Species-Specific Gamete Interaction during Sea Urchin Fertilization: Roles of the Egg Jelly and Vitelline Layer. Cells, 11(19), 2984; https://doi.org/10.3390/cells11192984
Limatola N, Chun JT, Santella L. (2022) Regulation of the Actin Cytoskeleton-Linked Ca2+ Signaling by Intracellular pH in Fertilized Eggs of Sea Urchin. Cells, 11(9), 1496; https://doi.org/10.3390/cells11091496
Limatola N, Chun JT, Cherraben S, Schmitt JL, Lehn JM, Santella L. (2021) Effects of dithiothreitol on Fertilization and early development in sea urchin. Cells, 10(12), 573; https://doi.org/10.3390/cells10123573
Limatola N, Vasilev F, Santella L, Chun JT. (2020) Nicotine induces polyspermy in sea urchin eggs through a non-cholinergic pathway modulating actin dynamics. Cells , 9(1), 63; https://doi.org/10.3390/cells9010063
Santella L, Limatola N, Chun JT. (2020) Cellular and molecular aspects of oocyte maturation and Fertilization: a perspective from the actin cytoskeleton. Zool Lett., 6, 1-21; https://link.springer.com/article/10.1186/s40851-020-00157-5
Limatola N, Chun JT & Santella L. (2020) Effects of salinity and pH of seawater on the reproduction of the sea urchin Paracentrotus lividus. Biol Bull., 239, 13-23.
Limatola N, Vasilev F, Chun JT & Santella L. (2019) Sodium-mediated fast electrical depolarization does not prevent polyspermic Fertilization in Paracentrotus lividus eggs. Zygote, 27, 241-24.
Vasilev F, Limatola N, Chun JT & Santella L. (2019) Contributions of suboolemmal acidic vesicles and microvilli to the intracellular Ca2+ increase in the sea urchin eggs at Fertilization. Int J Biol Sci., 15, 757; https://www.ijbs.com/v15p0757.htm
Limatola N, Vasilev F, Chun JT & Santella L. (2019) Altered actin cytoskeleton in ageing eggs of starfish affects fertilization process. Exp Cell Res., 381, 179-190.
Limatola N, Chun JT, Kyozuka K, Santella L. (2015) Novel Ca2+ increases in the maturing oocytes of starfish during the germinal vesicle breakdown. Cell Calcium, 58, 500-510.
Chun JT, Limatola N, Vasilev F, Santella L. (2014) Early events of Fertilization in sea urchin eggs are sensitive to actin-binding organic molecules. Biochem Biophys Res Commun., 450, 1166-74.
Vasilev F, Chun JT, Gragnaniello G, Garante E, Santella L. (2012). Effects of ionomycin on egg activation and early development in starfish. PLoS One, 7, e39231; https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0039231
Chun JT, Puppo A, Vasilev F, Gragnaniello G, Garante E, Santella L. (2010) The biphasic increase of PIP2 in the fertilized eggs of starfish: new roles in actin polymerization and Ca2+ signaling. PLoS One, 5, e14100; https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0014100
Puppo A, Chun JT, Gragnaniello G, Garante E, Santella L. (2008). Alteration of the cortical actin cytoskeleton deregulates Ca2+ signaling, monospermic Fertilization, and sperm entry. PLoS One 3, e3588; https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0003588
Kyozuka K, Chun JT, Puppo A, Gragnaniello G, Garante E, Santella L. (2008). Actin cytoskeleton modulates calcium signaling during maturation of starfish oocytes. Dev Biol., 320, 426-35.
Lim D, Ercolano E, Kyozuka K, Nusco GA, Moccia F, Lange K, Santella L. (2003) The M-phase-promoting factor modulates the sensitivity of the Ca2+ stores to inositol 1, 4, 5-trisphosphate via the actin cytoskeleton. J Biol Chem., 278, 42505-42514; https://www.jbc.org/article/S0021-9258(20)82794-X/fulltext
Lim D, Lange K, Santella L. (2002) Activation of oocytes by latrunculin A. The FASEB J., 16, 1050-1056.
Lim D, Kyozuka K, Gragnaniello G, Carafoli E, Santella L. (2001) NAADP+ initiates the Ca2+ response during Fertilization of starfish oocytes. The FASEB J., 15, 2257-226.
Santella L. , Kyozuka K. (1994) Reinitiation of meiosis in starfish oocytes requires an increase in nuclear Ca2+. Biochem Biophys Res Commun., 203, 674-680.
Websites or online articles
2015 Small World in Motion Competitionn (Video)
International Symposium - The dynamically active egg: The legacy of Ernest Everett Just
Everett_Just_at_the_Stazione_Zoologica_in_Naples_Celebration_of_a_Friendship
Foto

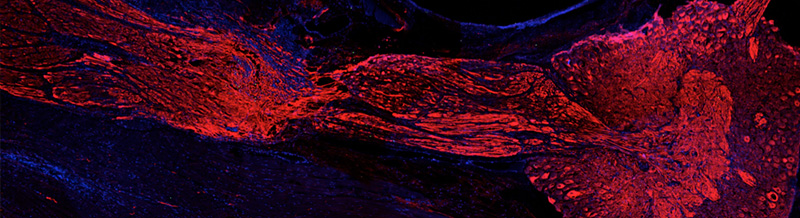
Marcatura fluorescente di spermatozoi e involucri ovulari di Paracentrotus lividus in vivo. (A) Spermatozoi diluiti in acqua di mare naturale contenente la poliammina BPA-C8-Cy3 (verde) e Hoechst-33342 (blu). Un uovo di riccio intatto marcato con la lectina concanavalin A (Con A) fluorescente (Alexa Fluor 633 Con A) osservato al microscopio in modalità non confocale che consente la visualizzazione del rivestimento gelatinoso (JC, jelly coat). (C) Due uova denudate della matrice extracellulare marcate con Alexa Fluor 633 Con A e osservate in modalità non confocale.

Microscopia elettronica a trasmissione e scansione dei cambiamenti della superficie durante la fecondazione di uova di riccio di mare.

Fusione dello spermatozoo di riccio di mare con l’uovo al di sotto della membrana di fecondazione.
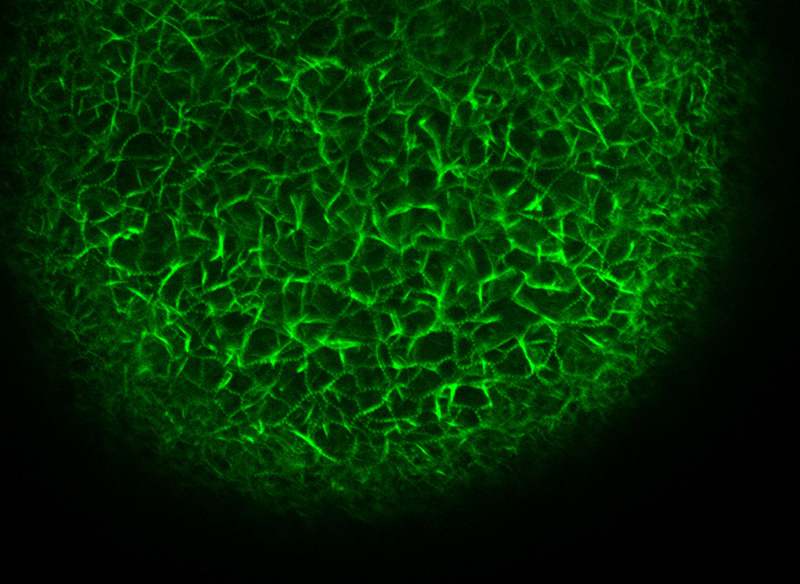
Filamenti di actina in un ovocita di stella di mare microiniettato con falloidina coniugata con Alexa 568.
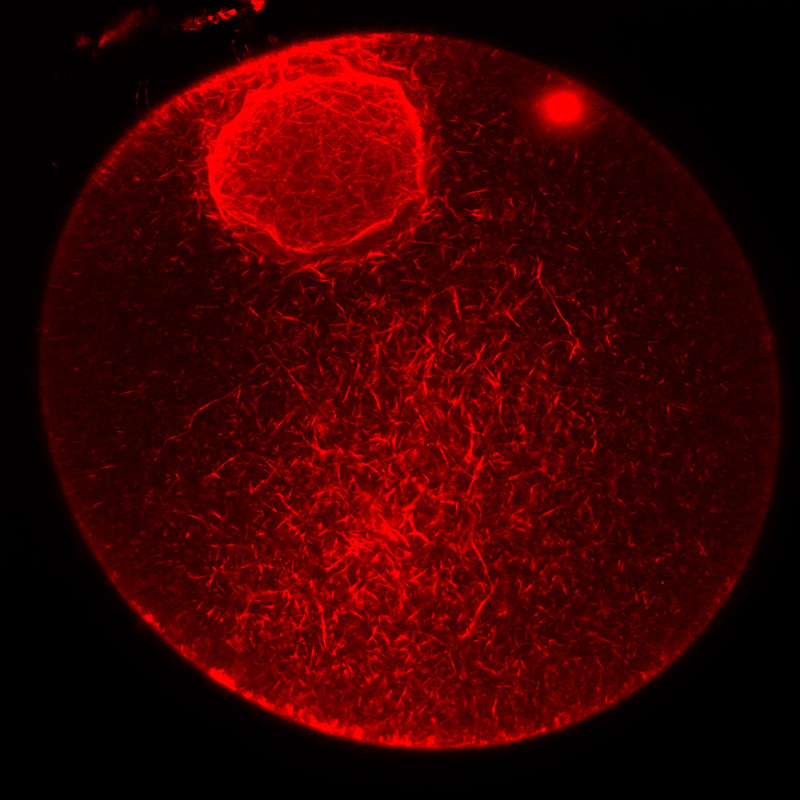
Filamenti di actina nel nucleo e citoplasma di un ovocita immaturo di stella di mare.

Formazione di spikes di actina nello spazio perivitellino di un uovo di stella di mare dopo attivazione visualizzate con il dominio PH della PLC1.
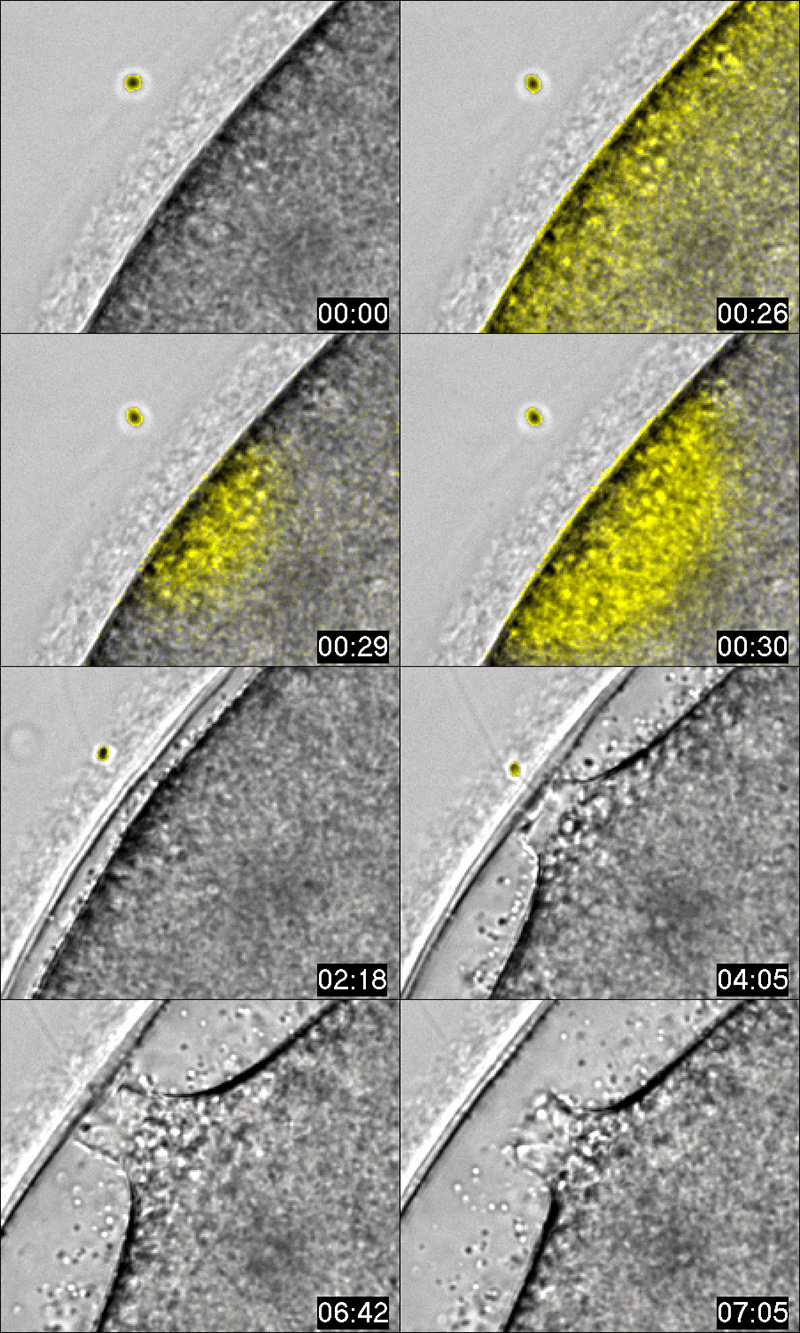
L’interazione dello spermatozoo fecondante (cerchietto giallo) con la superficie dell'uovo di stella di mare induce aumenti di Ca2+ intracellulare (fluorescenza gialla) attraverso il filamento acrosomiale che è visibile a 04:05. Visione dettagliata del sito d’ingresso dello spermatozoo nell’uovo durante la fecondazione.

Incorporazione dello spermatozoo nell’uovo di stella di mare mediante protrusioni citoplasmatiche attraverso la membrana di fecondazione.