Le uova di riccio di mare, fecondate in condizioni sperimentali che utilizzano un'alta densità di spermatozoi, vanno incredibilmente incontro ad una fecondazione monospermica. Ciò ha suggerito l'idea dell’esistenza di meccanismi che impediscono l’entrata di spermatozoi soprannumerari. I nostri precedenti studi sulla fecondazione di uova di stelle e ricci di mare hanno ampiamente dimostrato che il delicato controllo del citoscheletro di actina corticale dell'uovo regola la fecondazione monospermica1-3. Nel presente studio, abbiamo testato questa ipotesi dal momento che è noto da tempo che la nicotina induce alti tassi di fecondazione polispermica nelle uova di ricci di mare4. Pertanto, la polispermia indotta dalla nicotina comporta anche la deregolazione dell’actina del citoscheletro dell’ uovo? Quale potrebbe essere il meccanismo alla base di questo? Poiché la nicotina è un agonista dei recettori ionotropici dell'acetilcolina (ACh), abbiamo lavorato all’ipotesi che la polispermia potesse essere indotta dall'attivazione di una via di segnalazione che coinvolge il recettore nicotinico di ACh (nAChR). Con nostra sorpresa, però, i risultati dei nostri esperimenti condotti nel corso di numerose stagioni riproduttive dei ricci di mare, hanno sempre evidenziato che il nAChR non svolge alcun ruolo nell’indurre la polispermia nelle uova trattate con nicotina. Gli agonisti del nAChR non riproducono l'effetto della nicotina e, mentre gli inibitori del nAChR falliscono nell’attenuare la polispermia indotta dalla nicotina, gli inibitori della polimerizzazione dell'actina riescono a farlo. I nostri dati suggeriscono quindi che la nicotina, attraversando la membrana plasmatica dell'uovo agisca direttamente sull’organizzazione strutturale dell’actina del citoscheletro del cortex. La modificazione della struttura dell’actina e conseguente alterazione della dinamica e funzionalità della sua polimerizzazione, aumenterebbero la ricettività dell’uovo agli spermatozoi5.
Inoltre, i risultati di questo lavoro hanno sollevato diversi punti importanti da considerare:
[1] Il numero di spermatozoi incorporati nell'uovo aumenta proporzionalmente con la dose di nicotina disciolta nell’acqua di mare.
[2] La nicotina inibisce la formazione della membrana di fecondazione, ma ciò non è correlato al numero di spermatozoi incorporati nell'uovo.
[3] L'esposizione delle uova alla nicotina per alcuni minuti induce l'iperpolimerizzazione dell'actina nella regione al disotto della membrana plasmatica in maniera dose-dipendente.
[4] La nicotina microiniettata e non gli agonisti del nAChR, induce alterazioni dei filamenti di actina e polispermia.
[5] La nicotina altera la topografia della superficie dell'uovo, rendendola ondulata.
[6] In vitro, la cinetica di polimerizzazione dell'actina è accelerata dalla nicotina, mentre la cinetica di depolimerizzazione è inibita.
[7] In vitro, la nicotina inibisce l'azione depolimerizzante dell'actina ad opera della cofilina. Pertanto, l'effetto netto della nicotina è la promozione della polimerizzazione dell'actina.
Ancora più importante, la scoperta che la nicotina abbia significativi effetti sulla struttura del citoscheletro di actina e sulla fisiologia delle uova di riccio di mare suggerisce che questo noto alcaloide, possa agire anche su altri sconosciuti pathways delle cellule animali.
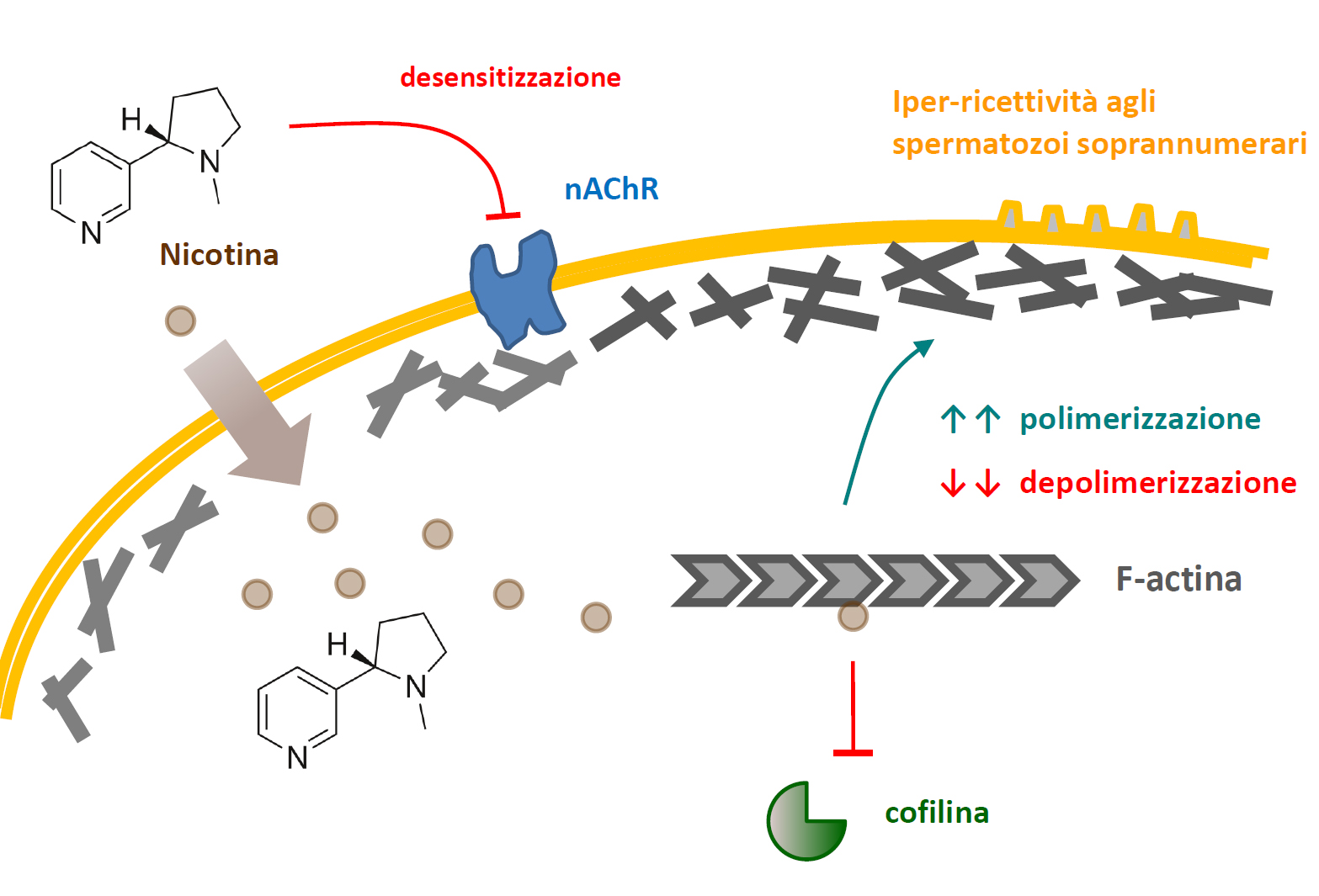
Figura 1. Modello proposto per il meccanismo della polispermia indotta dalla nicotina. I recettori nicotinici dell'acetilcolina (nAChR) possono esistere sulla superficie dell'uovo, ma la nicotina li ignora o addirittura li desensibilizza. La maggior parte della nicotina nella sua forma non protonata permea la membrana cellulare e cambia la struttura e la funzione del citoscheletro di actina corticale. Questo si ottiene o agendo direttamente sulle molecole di actina oppure interferendo con le proteine che legano l'actina, come la cofilina. Di conseguenza, alla fecondazione, la corretta regolazione del citoscheletro di actina dell'uovo è compromessa, e ciò provoca l'ingresso di spermatozoi soprannumerari nell’uovo.
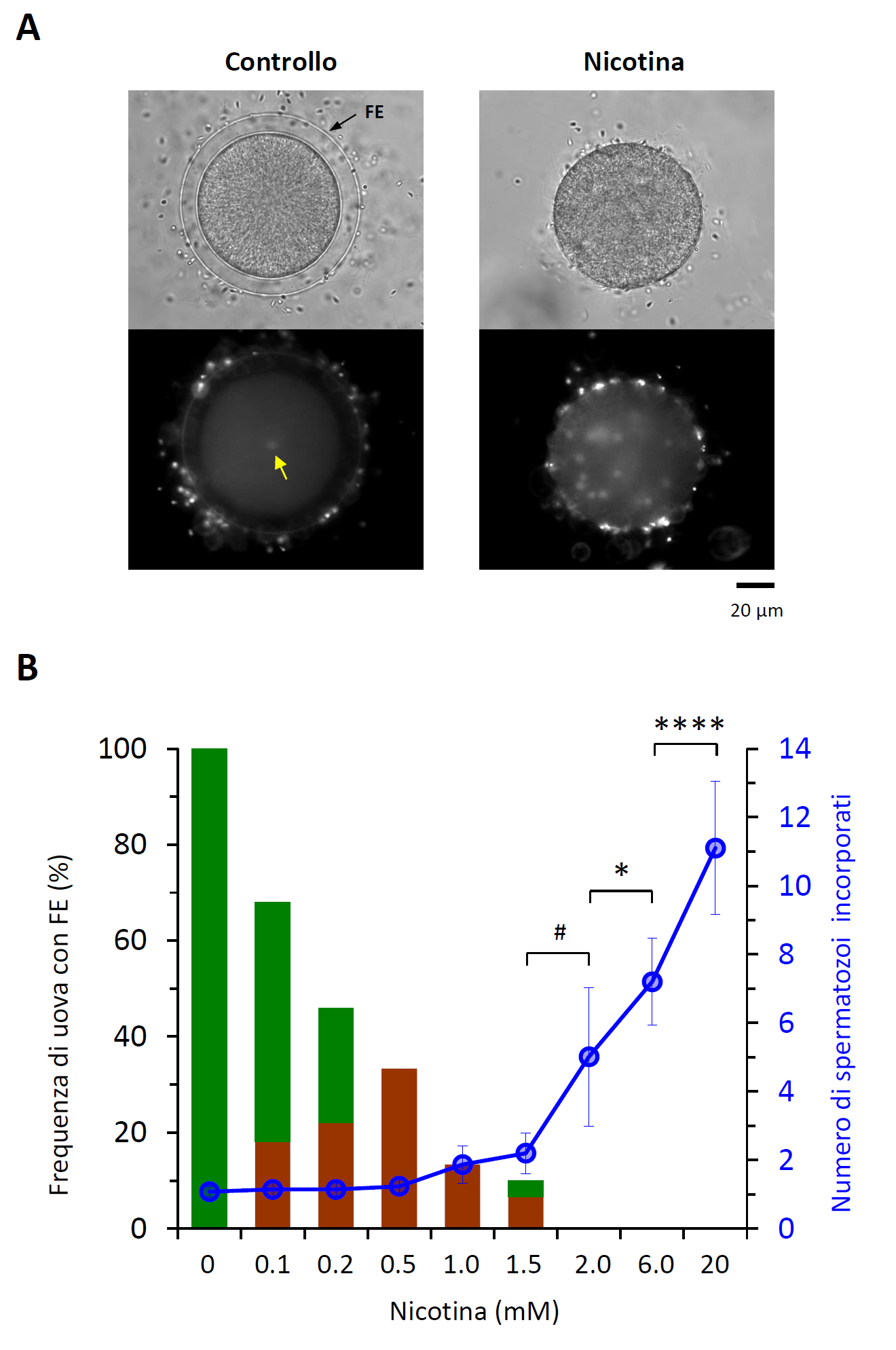
Figura 2. La nicotina induce la polispermia in modalità dose-dipendente. (A) Immagini al microscopio in campo chiaro ed epifluorescenza (in basso) che mostrano un uovo di riccio di mare di controllo e trattato con 6 mM nicotina prima della fecondazione. Mentre un singolo spermatozoo è visibile nell'uovo di controllo (freccia gialla), numerosi spermatozoi sono incorporati nelle uova trattate con nicotina. (B) Quantificazione degli spermatozoi incorporati nell'uovo e grado di sollevamento della membrana di fecondazione (FE). Le barre verdi nell'istogramma rappresentano le uova con completo sollevamento della FE, mentre le barre marroni indicano le uova che mostrano un modesto sollevamento della FE. #P<0.05, *P<0.01, ****P<0.00001.
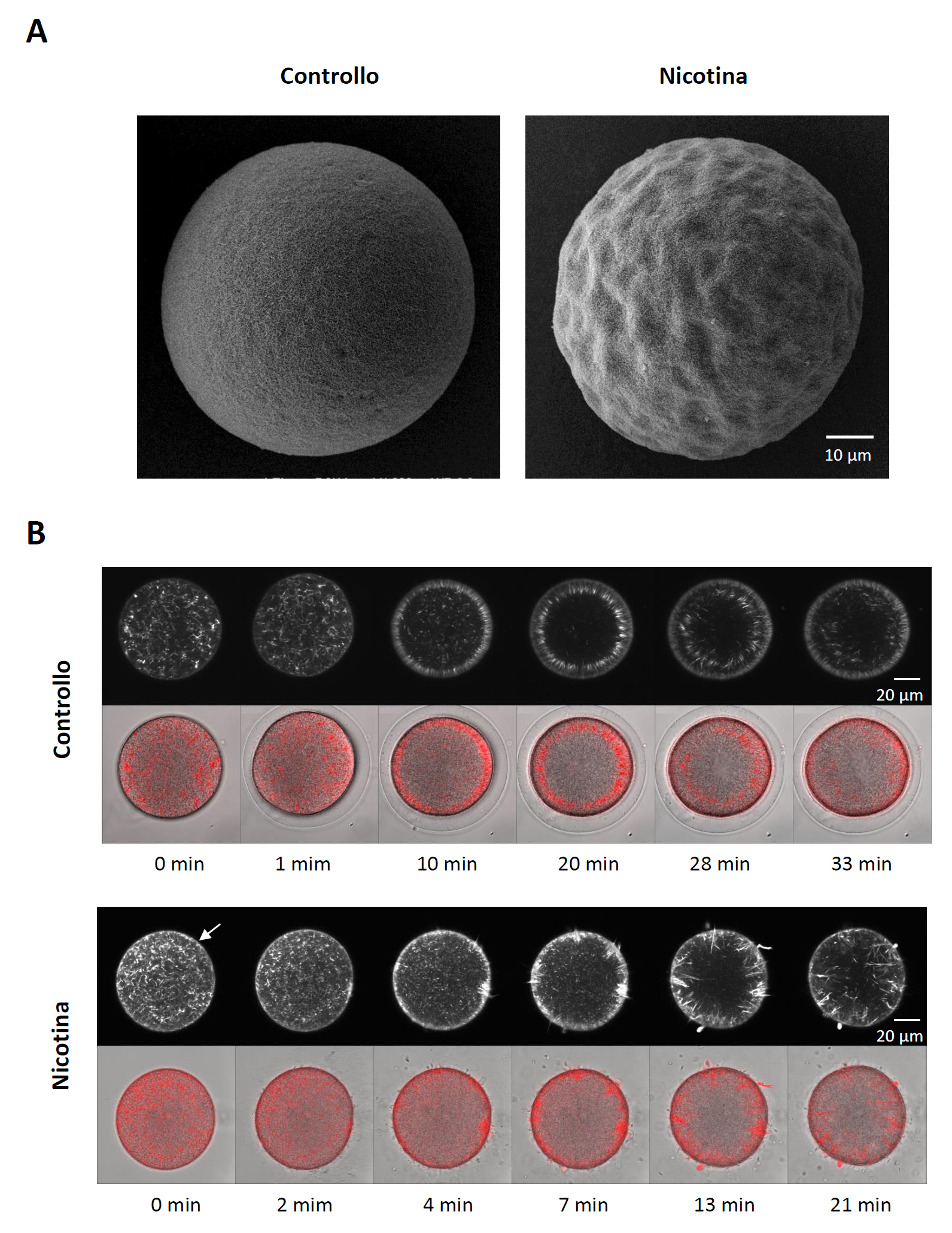
Figura 3. La nicotina rende la superficie dell'uovo iper-ricettiva agli spermatozoi soprannumerari. (A) Confronto della topografia della superficie cellulare delle uova prive dello strato gelatinoso mediante microscopia elettronica a scansione e dopo pretrattamento delle uova con nicotina 5 mM per 5 min. (B) Effetti della nicotina sulla mobilizzazione dei filamenti di actina corticale dopo fecondazione. Le uova di P. lividus sono state microiniettate con AlexaFluor568-Phalloidin e successivamente incubate in presenza o in assenza di 20 mM di nicotina per 5 minuti. Le uova sono state quindi fecondate in acqua di mare naturale e la distribuzione dei filamenti di actina è stata continuamente monitorata mediante microscopia confocale.
Riferimenti bibliografici
1. Puppo A, Chun JT, Gragnaniello G, Garante E, Santella L. (2008) Alteration of the cortical actin cytoskeleton deregulates Ca2+ signaling, monospermic fertilization, and sperm entry. PLoS One 3:e3588; doi: 10.1371/journal.pone.0003588.
2. Chun JT, Limatola N, Vasilev F, Santella L. (2014) Early events of fertilization in sea urchin eggs are sensitive to actin-binding organic molecules. Biochem Biophys Res Commun. 450:1166-74. doi: 10.1016/j.bbrc.2014.06.057.
3. Limatola N, Vasilev F, Chun JT, Santella L. (2019) Sodium-mediated fast electrical depolarization does not prevent polyspermic fertilization in Paracentrotus lividus eggs. Zygote. 27:241-249. doi: 10.1017/S0967199419000364.
4. Hertwig O, Hertwig R. (1887). Uber den Befruchtungs- und Teilungsvorgang des tierischen Eies unter dem Einfluss ausserer Agentien. Jen. Zeitschr., 20: 120.
5. Limatola N, Vasilev F, Santella L, Chun JT. (2020) Nicotine Induces Polyspermy in Sea Urchin Eggs through a Non-Cholinergic Pathway Modulating Actin Dynamics. Cells. 9(1). pii: E63. doi: 10.3390/cells9010063.