Ruolo dello strato gelatinoso e involucro vitellino dell’uovo
Nonostante la notevole diversità strutturale di uova e spermatozoi delle specie animali e il diverso comportamento fisiologico, l’evento culminante del processo di fecondazione, che dipende dal riconoscimento specie-specifico, è la fusione dello spermatozoo con la membrana plasmatica dell'uovo per la trasduzione dei segnali. La sequenza degli eventi cellulari e molecolari che caratterizzano il processo di fecondazione è stata studiata intensamente nel riccio di mare. L’ipotesi corrente è che lo spermatozoo fecondante vada incontro a modifiche morfologiche (reazione acrosomale, AR) una volta interagito con lo strato gelatinoso esterno che avvolge l'uovo. Tale contatto induce la formazione del processo acrosomale in seguito alla polimerizzazione di actina sulla testa dello spermatozoo. Il filamento acrosomale espone così la "bindina", una proteina adesiva che è essenziale per l'interazione specie-specifica dello spermatozoo con il recettore presente sull’involucro vitellino dell’uovo (riassunto grafico). Per studiare il ruolo specifico dello strato gelatinoso e dell’involucro vitellino dell’uovo durante la fecondazione del riccio di mare, le uova di Paracentrotus lividus sono state incubate in acqua di mare acida (pH 5.5), per rimuovere lo strato gelatinoso, cioè in condizioni sperimentali che dovrebbero prevenire la AR che necessita di un pH alcalino, ed inseminate nello stesso mezzo. In contrasto con l'opinione prevalente, i nostri risultati hanno dimostrato che le uova di P. lividus degelatinizzate possono ancora interagire e fondersi con lo spermatozoo fecondante nell'acqua di mare acida, anche se con una risposta di fecondazione alterata.
Inoltre uova di P. lividus private dell’involucro vitellino e dello strato gelatinoso ad esso legato interagiscono con spermatozoi multipli (fecondazione polispermica) e con segnali di Ca2+ alterati. I nostri risultati hanno fornito prove sperimentali che è la membrana plasmatica e non l’involucro vitellino dell’uovo, il sito dove il riconoscimento specifico tra i gameti avviene. La funzione dell’involucro vitellino che ricopre la membrana plasmatica sarebbe quella di prevenire la polispermia, poiché la sua rimozione favorisce il legame, fusione di più spermatozoi con la membrana plasmatica ed il loro ingresso nell’uovo. Pertanto, l'integrità della struttura dell’involucro vitellino è essenziale per mascherare i multipli siti fusogenici che risiedono nella membrana plasmatica, la cui esposizione indurrebbe una fecondazione omologa polispermica. I nostri risultati sulla presenza di recettori che riconoscono quelli dello spermatozoo della stessa specie sulla membrana plasmatica e non sull’involucro vitellino possono aiutarci a comprendere il ruolo svolto dall’involucro vitellino in uova di specie diverse ai fini di identificare i meccanismi molecolari di base comuni che regolano la fecondazione in altri gruppi animali.
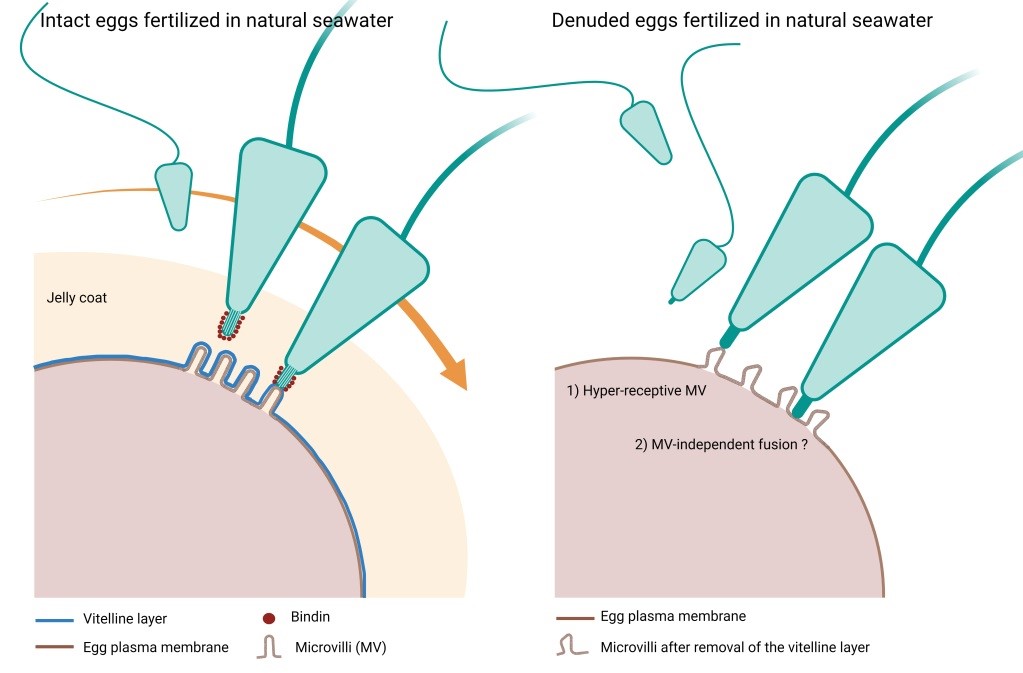 Fecondazione in acqua di mare naturale di uova di P. lividus intatte (con strato gelatinoso e involucro vitellino) e denudate. I microvilli sulla membrana plasmatica delle uova di riccio di mare intatte sono strettamente ricoperti dall’involucro vitellino (vitelline layer) a sua volta circondato dal rivestimento gelatinoso (jelly coat). Secondo l'opinione prevalente, quando lo spermatozoo fecondante raggiunge lo strato gelatinoso, subisce alterazioni morfo-funzionali dovute alla polimerizzazione dell'actina nella testa dello spermatozoo, che forma il processo acrosomale. Una proteina adesiva "bindin" esposta sul filamento acrosomale è responsabile del riconoscimento specie-specifico tra le membrane dei gameti e la conseguente fusione dello spermatozoo con l'uovo. I nostri risultati hanno dimostrato che dopo inseminazione la rimozione dell’involucro vitellino e dello strato gelatinoso ad esso legato, promuove l’interazione, fusione ed entrata di più spermatozoi omologhi nelle uova prive di involucri nonostante gli spermatozoi non siano andati incontro alla reazione acrosomale. Al contrario, uova di P. lividus denudate dei rivestimenti ovulari non incorporano spermatozoi di altre specie. Pertanto, il controllo della specificità della specie tra i gameti del riccio di mare risiede a livello della membrana plasmatica, e non dell’involucro vitellino che ha la funzione di inibire la fecondazione polispermica.
Fecondazione in acqua di mare naturale di uova di P. lividus intatte (con strato gelatinoso e involucro vitellino) e denudate. I microvilli sulla membrana plasmatica delle uova di riccio di mare intatte sono strettamente ricoperti dall’involucro vitellino (vitelline layer) a sua volta circondato dal rivestimento gelatinoso (jelly coat). Secondo l'opinione prevalente, quando lo spermatozoo fecondante raggiunge lo strato gelatinoso, subisce alterazioni morfo-funzionali dovute alla polimerizzazione dell'actina nella testa dello spermatozoo, che forma il processo acrosomale. Una proteina adesiva "bindin" esposta sul filamento acrosomale è responsabile del riconoscimento specie-specifico tra le membrane dei gameti e la conseguente fusione dello spermatozoo con l'uovo. I nostri risultati hanno dimostrato che dopo inseminazione la rimozione dell’involucro vitellino e dello strato gelatinoso ad esso legato, promuove l’interazione, fusione ed entrata di più spermatozoi omologhi nelle uova prive di involucri nonostante gli spermatozoi non siano andati incontro alla reazione acrosomale. Al contrario, uova di P. lividus denudate dei rivestimenti ovulari non incorporano spermatozoi di altre specie. Pertanto, il controllo della specificità della specie tra i gameti del riccio di mare risiede a livello della membrana plasmatica, e non dell’involucro vitellino che ha la funzione di inibire la fecondazione polispermica.
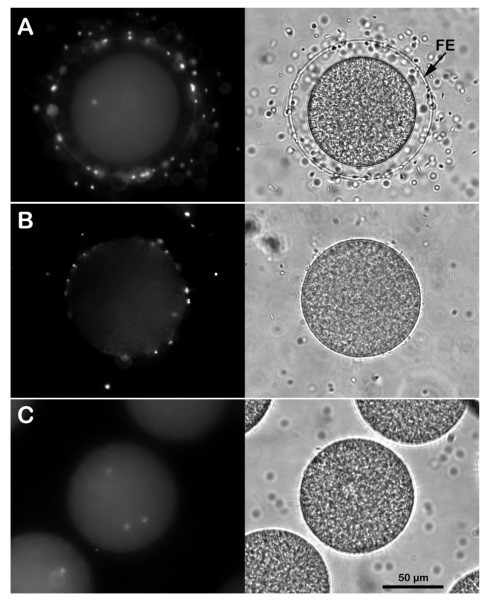 Effetto della rimozione dello strato gelatinoso e involucro vitellino sull’entrata degli spermatozoi. (A) Le uova intatte di P. lividus fecondate in acqua di mare naturale (NSW) con spermatozoi marcati con DNA fluorescente vengono penetrate da un solo spermatozoo, come mostrato nell’immagine scattata al microscopio ad epifluorescenza 5 minuti dopo l'inseminazione. La membrana di fecondazione (FE) è completamente sollevata attorno allo zigote, come mostrato nell'immagine a luce trasmessa. La fecondazione monospermica o l'inibizione dell'entrata degli spermatozoi si osserva nelle uova di P. lividus incubate per 5 minuti in acqua di mare acida (pH 5.5) e fecondate nello stesso mezzo (B). Si noti che a differenza del controllo in A, è difficile visualizzare il sollevamento della FE nelle uova fecondate in acqua di mare acida a causa delle modifiche strutturali della superficie delle uova indotte dal pH acido dell'acqua di mare. L'incorporazione multipla di spermatozoi della stessa specie si osserva quando le uova di P. lividus sono fecondate in NSW dopo trattamento con DTT 10 mM a pH 9 per 20 minuti per rimuovere l’involucro vitellino e lo strato gelatinoso (C).
Effetto della rimozione dello strato gelatinoso e involucro vitellino sull’entrata degli spermatozoi. (A) Le uova intatte di P. lividus fecondate in acqua di mare naturale (NSW) con spermatozoi marcati con DNA fluorescente vengono penetrate da un solo spermatozoo, come mostrato nell’immagine scattata al microscopio ad epifluorescenza 5 minuti dopo l'inseminazione. La membrana di fecondazione (FE) è completamente sollevata attorno allo zigote, come mostrato nell'immagine a luce trasmessa. La fecondazione monospermica o l'inibizione dell'entrata degli spermatozoi si osserva nelle uova di P. lividus incubate per 5 minuti in acqua di mare acida (pH 5.5) e fecondate nello stesso mezzo (B). Si noti che a differenza del controllo in A, è difficile visualizzare il sollevamento della FE nelle uova fecondate in acqua di mare acida a causa delle modifiche strutturali della superficie delle uova indotte dal pH acido dell'acqua di mare. L'incorporazione multipla di spermatozoi della stessa specie si osserva quando le uova di P. lividus sono fecondate in NSW dopo trattamento con DTT 10 mM a pH 9 per 20 minuti per rimuovere l’involucro vitellino e lo strato gelatinoso (C).
Limatola N, Chun JT, Santella L. Species-Specific Gamete Interaction during Sea Urchin Fertilization: Roles of the Egg Jelly and Vitelline Layer. September 2022Cells 11(19):2984.
Riferimenti bibliografici correlati
Epel D Weaver, A M, Mazia D. Methods for removal of the vitelline membrane of sea urchin eggs. Exp. Cell Res. 1970, 61, 64-68. doi:10.1016/0014-4827(70)90257-0.
Lillie FR. The production of sperm-isoagglutinins by ova. Science 1912, 36, 527-530. doi: 10.1126/science.36.929.527.
Limatola N, Chun JT, Santella L. Regulation of the actin cytoskeleton-linked Ca2+ signaling by intracellular pH in fertilized eggs of sea urchin. Cells 2022, 11, 149. doi: 10.3390/cells11091496.
Limatola N, Chun JT, Cherraben S, Schmitt JL, Lehn JM, Santella L. Effects of Dithiothreitol on fertilization and early development in sea urchin. Cells. 2021, 10, 3573. doi: 10.3390/cells10123573.
Tilney LG, Hatano S, Ishikawa H, Mooseker MS. The polymerization of actin: its role in the generation of the acrosomal process of certain echinoderm sperm. J. Cell Biol. 1973, 59, 109-126. doi: 10.1083/jcb.59.1.109.
Vacquier VD, Moy GW. Isolation of bindin: The protein responsible for adhesion of sperm to sea urchin eggs. Proc. Natl. Acad. Sci. USA 1977, 74, 2456-2460. doi: 10.1073/pnas.74.6.2456.
Vacquier VD, Tegner MJ, Epel D. Protease activity establishes the block against polyspermy in sea urchin eggs. Nature 1972, 240, 352-353. doi: 10.1038/240352a0.
Wessel GM, Wada Y, Yajima M, KiyomotoM. Bindin is essential for fertilization in the sea urchin. Proc. Natl. Acad. Sci. USA . 2021, 24;118:e2109636118.